
Efeu - Symbol des Lebens
- Efeu - eine Pflanze der Götter
- Efeu als Quelle für Biodiversität und menschliches Wohlbefinden
- Die Rolle des Efeus (Hedera helix) in der Kosmetik und Körperpflege
- Bedeutung des Efeus in der Pflanzenheilkunde
- Botanische Besonderheiten des Efeus
- Efeu - eine Ausnahmeerscheinung unserer mitteleuropäischen Pflanzenwelt
- Efeu - Blütenaufbau und Insektenbesuch
- Efeu als Quelle für Biodiversität und Nutznießer der Tiervielfalt
Efeu - eine Pflanze der Götter
Der Efeu (Hedera helix) ist in vielerlei Hinsicht eine faszinierende Pflanze, die aufgrund ihrer besonderen Eigenschaften einzigartig unter den Pflanzenarten unserer mitteleuropäischen Flora dasteht. Der Efeu gehört zu den Elementen der Biodiversität der Wälder Europas, das seit Jahrhunderten einen festen Platz in der Mythologie, Pflanzenheilkunde und der Schönheitspflege einnimmt. Sowohl bei den Ägyptern, den Griechen und Römern als auch bei den Kelten und Germanen spielte der Efeu als Kultpflanze in den jeweiligen Religionen eine wichtige Rolle. Bei den Ägyptern war der Efeu dem Fruchtbarkeitsgott und Herrscher des Totenreichs Osiris geweiht, bei den Griechen und Römern dagegen den Weingöttern Dionysos und Bacchus. Die keltischen Druiden sahen in ihm, ähnlich den Christen, ein heiliges Symbol des Lebens, denn der Efeu ist – für unsere mitteleuropäische Vegetation höchst ungewöhnlich - immergrün und scheint niemals zu sterben. Der Efeu stand gleichermaßen für Unvergänglichkeit, Unsterblichkeit und Wiedergeburt.[93]. Für Hippokrates (460 v. Chr. - 370 v. Chr.) stellt der Efeu die Quintessenz ewiger Lebenskraft dar.[89] Auch die Germanen verehrten den Efeu und verwendeten ihn zur Bekränzung der Opferstiere.
Efeu als Quelle für Biodiversität und menschliches Wohlbefinden
Archäologische Untersuchungen lassen vermuten, dass der Efeu (Hedera helix) aufgrund seiner besonderen Eigenschaften seit Jahrtausenden von den Menschen in vielfältiger Weise genutzt wurde.[45,79] Hinweise auf seinen Einsatz in der Körperpflege reichen bis in die Zeit der Kelten zurück. Die ältesten bekannten schriftlichen Belege über die Verwendung des Efeus in der Heilkunde stammen aus dem 4. Jahrhundert vor Christus. Die Bedeutung des Efeus in diesen zwei für das menschliche Wohlbefinden essentiellen Bereichen, dürfte heutzutage sogar noch zugenommen haben. Der Stellenwert für die Schönheitspflege lässt sich an der Anzahl der Produkte, in denen Efeu als Bestandteil aufgeführt wird – in den einschlägigen Datenbanken werden 530 Produkte genannt – ermessen.[33,34,34,36] Neuere Untersuchungen rücken Efeu als potentiellen Rohstoff für neue Medikamente und Werkstoffe, z.B. neuartige Klebstoffe in den Fokus der Pharmaindustrie und der Produktentwickler.

In ihrer Rolle als Bestäuber nehmen die Insekten eine Schlüsselstellung in dieser Lebensgemeinschaft ein. Fotos: M. Neitzke
Wie alle Pflanzen ist der Efeu ein Teil des Netzes aus gegenseitigen Abhängigkeiten und Beeinflussungen in einer Lebensgemeinschaft. An ihm wird die Rolle einer Pflanze als Begünstigte und als Quelle für Biodiversität besonders deutlich. So ist der Efeu zur Blütezeit nicht nur Nahrungsquelle für eine enorme Vielfalt an Insekten (bis zu 89 verschiedene Insektenarten wurden beobachtet [57, 63], sondern ist bei seiner Bestäubung in hohem Maße auch auf die Insekten angewiesen. Versuche, in denen durch Ausschluss von Insekten eine Bestäubung durch diese verhindert wurde, zeigten eine signifikante Reduktion des Fruchtansatzes.[41] In ihrer Rolle als Bestäuber nehmen die Insekten eine Schlüsselstellung in dieser Lebensgemeinschaft ein. Die Bestäubungsaktivität der Insekten sorgt nämlich nicht nur für eine Bestäubung und damit Fruchtbildung, sondern auch für eine ständige Vermischung des Erbgutes. Die sich dadurch ergebende genetische Diversität ist Grundlage für die chemische Diversität in einer Pflanze, also auch der des Efeus. Die ungeheure Mannigfaltigkeit an chemischen Verbindungen, den sekundären Pflanzenstoffen, in einer Pflanze, ist die Grundlage für die vielfältigen Verwendungsmöglichkeiten in Schönheitspflege und der Medizin.

Zur Zeit der Fruchtreife bietet sie Nahrung für mehr als 17 Vogelarten und im Herbst und Winter Futter für Rehe und Hirsche.
Die Rolle des Efeus (Hedera helix) in der Kosmetik und Körperpflege
Den Druiden der Kelten verdanken wir die ersten Hinweise auf ein Einsatzgebiet des Efeus in der Körperpflege, das auch heute noch zu seinen bekanntesten gehört, der Behandlung von Cellulite. So sollen die Druiden-Ärzte der Kelten Efeu häufig zur Straffung und Festigung von schwabbelig gewordenem Gewebe verwendet haben.[93].
Heute sind Efeuextrakte aufgrund ihrer vielfältigen Eigenschaften in vielen Körperpflegeprodukten, darunter Reinigungs- und Pflegeprodukten enthalten. Die Palette umfasst Duschgele, Shampoos, Seifen, Peelings, Cremes, Masken, Massageöle, Sonnenschutzprodukte und Pflegelotionen. Auch bei der Entwicklung von Produkten zur Behandlung besonderer Probleme, wie einer juckenden, trockenen Haut, einer unerwünschten starken Pigmentierung oder von Cellulite bedient sich die Kosmetikindustrie gerne bei der Efeupflanze. Aufgrund der allergenen und photosensibilisierenden Wirkung einiger Inhaltsstoffe des Efeus sollte man das Herstellen von Körperpflegeprodukten den Fachleuten überlassen.

In den Produkten wirken Efeuextrakte u.a. hautpflegend, zusammenziehend (adstringierend), antimikrobiell, antioxidativ und entzündungshemmend.[8, 9, 46] Sie fördern die Durchblutung und den Lymphfluss und reduzieren die Talgproduktion.[11, 49, 84, 98, 99, 100]

Grundlage dieses breiten Anwendungsspektrums in der Körper- und Schönheitspflege ist das Vorhandensein zahlreicher bioaktiver Inhaltsstoffe.
Gewöhnlicher Efeu (Hedera helix) – ein Wirkstoffcocktail, der es in sich hat
Das komplexe Gemisch von sekundären Pflanzenstoffen in den Efeuextrakten verfügt über ein sehr breites Wirkungsspektrum. Für eine Reihe von Inhaltsstoffen konnten für Fragestellungen, die für die Körper- und Schönheitspflege von Interesse sind, spezifische Wirkungen nachgewiesen werden. Die Ergebnisse dieser Untersuchungen können uns helfen, die komplexe Wirkung der Efeuextrakte zu verstehen. Dabei darf jedoch nicht vergessen werden, dass sich die einzelnen Komponenten in einer Pflanze gegenseitig in ihrer Wirkung beeinflussen und die Wirkung eines Stoffes von dem Vorliegen oder Fehlen anderer Stoffe entscheidend beeinflusst werden kann. Die Wirkung eines Gesamtauszuges einer Pflanze ist mehr als die Summe der Wirkungen der Einzelkomponenten. Dennoch soll im Folgenden versucht werden, die Wirkung einzelner bedeutsamer sekundärer Pflanzenstoffe im Hinblick auf ihre Wirkung in Körperpflegeprodukten zu beleuchten.

Die wichtigsten bioaktiven Verbindungen im Efeu, sowohl in Bezug auf ihre Häufigkeit als auch ihre Bedeutung, sind die Saponine.[7] Die Saponine besitzen eine große Strukturvielfalt und eine hohe Variabilität in ihren biologischen Eigenschaften. Für die auswurffördernde, krampflösende und schleimverflüssigende Wirkung von Efeuextrakten in Hustenmedikamenten sind sie ebenso mit verantwortlich wie für die Wirkungen auf Haut und Haare derentwegen sie in zahlreichen Körperpflegemitteln zum Einsatz kommen. Saponine sind bioaktive Substanzen, die die Fähigkeit besitzen in wässriger Lösung stark zu schäumen. Sie weisen dadurch eine gewisse Seifenähnlichkeit auf, eine Eigenschaft, der sie auch ihren Namen zu verdanken haben. Die Bezeichnung „Saponine“ beruht auf dem lateinischen Wort „sapo“, das übersetzt „Seife“ bedeutet. Wie Seife setzten sie die Oberflächenspannung des Wassers herab und können Schmutz und Fett lösen. Diese Wirkungsweise steht bei Verwendung saponinhaltiger Pflanzen in Körperpflegemitteln im Vordergrund. In der Kosmetik werden Saponine als Biotenside und Schaumbildner benutzt. Man findet sie daher in vielen Naturshampoos, Make-up Entfernern und anderen Reinigungspräparaten. Saponine wirken in Haarpflegemitteln jedoch nicht nur reinigend, sondern auch konditionierend, weshalb sie mit Erfolg in milden Haarwaschmitteln verwendet werden.[49] Saponine bilden mit Cholesterin Komplexe. Einige Saponine reinigen daher nicht nur, sondern ziehen auch auf die Cholesterin enthaltenden Haare auf und wirken so konditionierend (haarkonditionierend: macht das Haar leicht kämmbar, geschmeidig, weich und glänzend und verleiht ihm Volumen, haut.de). Außerdem wirken sich Saponine positiv auf die Feuchtigkeitsbindung der Hautbarriere aus.[49]
Die Wirksamkeit von Efeuextrakten in Anti-Cellulite Präparaten ist umstritten.[2, 92] Allerdings lassen einige Eigenschaften von Efeuextrakten und der aus Efeu extrahierten Saponine, wie z.B. die Verbesserung der Mikrozirkulation und eine entzündungshemmende, antioxidative, gefäßverengende und gefäßschützende Wirkung, einen positiven Effekt bei der Behandlung von Cellulite als plausibel erscheinen.[28, 29, 30, 54, 78, 97] Die gefäßschützende Wirkung der Saponine des Efeus beruht u. a. auf einer Hemmung der Aktivität von Enzymen, die Elastin und Hyaluronsäuren abbauen.[22, 23] Elastin und Hyaluronsäure sind zusammen mit Collagen die Hauptbestandteile der die Gefäße umgebenen Grundmasse (Matrix), die die Bewegung, den Schutz und die Ernährung der Blutgefäße ermöglicht. In einer doppeltblinden, Studie, in der die Versuchspersonen nach einer Zufallsmethode ausgewählt wurden (randomisiert) und Scheinpräparate (Placebos) erhielten, in der die Wirksamkeit eines auf die Haut aufgetragenen Gels aus einem Gemisch verschiedener Inhaltsstoffen für die Behandlung von Cellulite untersucht wurde, konnte eine Reduktion der mit Cellulite verbundenen Symptome festgestellt werden.[17] Da das Gel neben Efeu auch andere Pflanzenextrakte enthielt, ist eine Zuordnung des Anteils den der Efeuextrakt an der beobachteten Wirkung des Gels hatte, nicht möglich. Nach Lautenschläger (2016) steht bei dem Einsatz von Efeu-Extrakt bei der Hautpflege die Hemmung von Wassereinlagerungen (Ödemhemmung) im Vordergrund. Die Verhinderung von Wasseransammlungen im Gewebe (anti-ödematös) ist auf die Wirkung einer als α-Hederin bezeichneten Verbindung im Efeu zurückzuführen.[69] Diese Wirkung von Efeuextrakten erklärt die Verarbeitung von Efeuextrakten in abschwellend wirkenden Produkten, z. B. in Augencremes bei geschwollenen Augen.[94]
Für Körperpflege und Medizin gleichermaßen von Interessen dürften auch die antibakteriellen Eigenschaften von Efeuextrakten oder aus Efeu isolierten Saponinen sein. In zahlreichen Untersuchungen konnte gezeigt werden, dass sich diese antibakterielle Wirkung auch gegen zahlreiche multiresistente gefährliche Krankenhauskeime richtet.[14, 15, 64, 71, 86, 91] Eine antibakterielle Wirkung wurde sowohl für die Gesamtextrakte, als auch die Blätter, Blüten und Früchte nachgewiesen.[64] Auch die Wirkung gegen andere unliebsame Besiedler der Haut, sog. Dermatophyten, darunter Erreger des Fußpilzes und der Ringelflechte konnte experimentell nachgewiesen werden.[15, 86] Bei den Dermatophyten handelt es sich um Pilze, die sich in den äußeren Schichten der Oberhaut, in Haaren und Nägeln ansiedeln und vor allem bei immungeschwächten Menschen Hauterkrankungen verursachen können.
An dem breiten Wirkungsspektrum von Efeuextrakten sind auch die übrigen sekundären Pflanzenstoffe des Efeus beteiligt, wie z.B. die Phenolcarbonsäuren und Flavonoide. Die in Efeuextrakten nachgewiesenen Phenolsäuren tragen zur antioxidativen, antimikrobiellen und entzündungshemmenden Wirkung der Efeuextrakte bei. Für Kaffee- und Ferulasäure konnte experimentell eine Wirkung auf den Kollagenstoffwechsel gezeigt werden. Während für Kaffeesäure eine Steigerung der Kollagenproduktion nachgewiesen wurde[55 ,83] , zeigte sich für die Ferulasäure ein Schutz des Kollagens vor einem enzymatischen Abbau.[42, 44]Abbau. Darüber hinaus zeigt Ferulasäure weitere für die Kosmetikindustrie interessante Eigenschaften, wie z.B. die Fähigkeit das an der Hautpigmentierung beteiligte Enzym Tyrosinase zu hemmen und die Vermehrung von Melanozyten, der Zellen, die für die Färbung von Haut und Haaren verantwortlich sind, zu hemmen.[109] Ferulasäure wird daher in Kosmetikprodukten zur Hautaufhellung eingesetzt. Auch Efeuextrakte sind Bestanteil von Produkten zur Aufhellung von Sommersprossen und anderen als störend empfundenen Hautpigmentierungen.[62] Auch die in Efeuextrakten enthalten Flavonoide besitzen antioxidative, antibakterielle, pilzabtötende und entzündungshemmende Eigenschaften. Rutin wirkt gefäßschützend.
Für die Entwicklung einer neuen Generation von Sonnenschutzmitteln könnte eine Entdeckung in dem von den Haftwurzeln des Efeus ausgeschiedenen Schleim von Bedeutung sein. Die Haftwurzeln an den Sprossen einer Efeupflanze sondern einen klebrigen Schleim ab. Die in dem Schleim enthaltenen Nanopartikel können UV-Strahlung bis zu 4 mal so gut abhalten, wie die bisher häufig in Sonnenschutzprodukten eingesetzten Metalloxidnanopartikel (Titanoxid, Zinkoxid), deren gesundheitliche Unbedenklichkeit umstritten ist. Dies macht sie zu einem vielversprechenden Kandidaten für die Rolle als Sunblocker in Sonnenschutzmitteln. Auch weitere in ersten Laborversuchen nachgewiesene Eigenschaften wie gute Hautverträglichkeit, geringe Eindringtiefe in die Haut sowie eine gute biologischen Abbaubarkeit machen die Nanopartikel aus dem Sekret der Efeuwürzelchen zu einem vielversprechenden Kandidaten für die Rolle als Sunblocker in Sonnenschutzmitteln.[37, 49, 50, 103]

Die Haftwurzeln auf der Unterseite eines Sprossabschnittes sondern einen klebrigen Schleim ab, der die Eigenschaften eines „Superklebstoffes“ besitzt und der Pflanze die Haftung auf der Unterlage ermöglicht. Die in dem Schleim enthaltenen Nanopartikel besitzen die Fähigkeit zu Aufnahme (Absorption) von UV-Strahlung. Foto: M. Neitzke
Außer dem in Mitteleuropa verbreiteten Gewöhnlichen Efeu (Hedera helix) haben noch 17 weitere Arten aus der etwa 1500 Arten umfassenden Familie der Araliaceae, zu der der Efeu gehört, aufgrund ihrer Eigenschaften Einzug in die Kosmetikindustrie gehalten. Dazu gehören auch Arten, die uns aus der Pflanzheilkunde vertraut sind, wie der Ginseng (Panax ginseng) oder die Taigawurzel (Eleutherococcus senticosus, synonym: Acanthopanax senticosus). In ihren Heimatgebieten werden alle in der Kosmetikindustrie verwendeten Arten auch als Heilpflanzen in den dort verwurzelten Medizinsystemen eingesetzt. Hauptverbreitungsgebiet der Araliaceen sind die Tropen und Subtropen. Aber nicht nur mit dem Ginseng und der Taigawurzel ist der Gewöhnliche Efeu verwandt, sondern auch mit der Strahlenaralie (Schefflera) und der Zimmeraralie (Fatsia japonica), die uns als Zimmerpflanzen wohl bekannt sind. Aus der 6 Arten zählenden Gattung Hedera wird lediglich der in Ostasien verbreitete Japanische Efeu (Hedera rhombea) noch in der Kosmetikindustrie verwendet. Nur etwas mehr als 1 % der Artenvielfalt der Araliaceen wird also bisher in der Kosmetikindustrie genutzt. Das bedeutet, dass die Familie der Araliaceen noch viele ungehobene Schätze für die Kosmetikindustrie bereithalten könnte.
Bedeutung des Efeus in der Pflanzenheilkunde
Efeu spielt von alters her in den Kulturen Mittel- und Südeuropas, aber auch Ägyptens eine wichtige Rolle als Heilpflanze. Die Druiden-Ärzte der Kelten verwendeten Efeu häufig äußerlich als Mittel gegen Kopfschmerzen oder auch zur Straffung und Festigung von schwabbelig gewordenem Gewebe.[93] Überliefert sind auch Teile des Rituals, das beim Sammeln eingehalten werden musste, sollte die Anwendung ihre volle Wirksamkeit entfalten. Offensichtlich schien es die Heilkraft der Efeublätter bei Kopfschmerzen zu erhöhen, wenn diese in einem rot eingefärbten Tuch zuerst gesammelt und dann zerrieben wurden, bevor man sie als Umschlag auf Schläfen und Stirn aufbrachte. Die ältesten bekannten schriftlichen Belege über die Verwendung des Efeus in der Heilkunde stammen aus dem 4. Jahrhundert vor Christus. Hippokrates (460 v. Chr. -370 v. Chr.) beschreibt in seinen berühmten Schriften die Verwendung von Wurzeln, Blättern und Beeren als Arzneimittel zur inneren und äußeren Anwendung. Überliefert ist der Einsatz von Efeu bei der Heilung von Entzündungen und Wunden. In Wein getauchte Blätter dienten äußerlich angewendet als adstringierendes (zusammenziehendes) Mittel, besonders zum Heilen von Geschwüren. Die Wurzeln des Efeus mit Wasser gekocht, nebst Wein, Mehl und Öl wurden als Breiumschlag bei entzündetem „vorgefallenem After„ eingesetzt.[16] Die Behandlung von Geschwüren und Wunden mit Hilfe von Zubereitungen des Efeus hat sich bis heute in der Volksheilkunde einiger Ländern gehalten.[12,59] Die Ergebnisse neuerer Untersuchungen der pharmakologischen Eigenschaften des Efeus unterstützen die Plausibilität des Einsatzes von Efeu in diesem Zusammenhang.[59] Offiziell anerkannt ist in Deutschland die Anwendung bei akuten und chronischen Erkrankungen der Atemwege.[5, 20, 21, 73, 74]

Verwendet werden in der Phytotherapie die 3 - 5 eckig gelappten im Frühjahr bis Frühsommer gesammelten Blätter nicht blühender Sprosse aus dem unteren Bereich der Pflanze.
Die Anwendungen in der Homöopathie sind weiter gefasst.[74, 75] Zu den Einsatzgebieten homöopathischer Zubereitungen gehören u.a.:
- Entzündungen der Atemwege
- Erkrankungen der Verdauungsorgane
- Schilddrüsenüberfunktion
- Rheumatische Erkrankungen
- Nervenschmerzen

Für homöopathische Zubereitungen werden die frischen unverholzten Sprosse verwendet. Foto: M. Neitzke
Weitere Eigenschaften des Efeus, die nicht nur vom medizinischen Standpunkt aus betrachtet, interessant sind, sondern auch im Zusammenhang mit der Herstellung von Körperpflegeprodukten bedeutsam sind, konnten in Laboruntersuchungen nachgewiesen werden. Es handelt sich dabei vor allem um eine antioxidative, antibakterielle, Pilze abtötende und entzündungshemmende Wirkung sowie eine Förderung der Wundheilung.[1, 53, 58, 61, 65, 76, 78, 87]
In Experimenten konnte auch der Einfluss auf zahlreiche Stoffwechselgeschehen sowie eine Wirkung gegen Viren gezeigt werden, die möglicherweise bei der Entwicklung neuer Medikamente eine Rolle spielen könnten.[3, 40, 81]

Andere Eigenschaften des Efeus könnten bei der Entwicklung neuer Entwurmungsmittel für die Tierhaltung oder umweltverträglicherer pilzabtötender Mittel eine Rolle spielen. In Versuchen zeigten Efeuextrakte eine Wachstumsreduktion phytopathogener Pilze und parasitischer Eingeweidewürmer, wie dem Gedrehten oder Roten Magenwurm, der Schafe und Ziegen befällt[18,56, 68] sowie von Leberegeln.[43] Diese Wirksamkeit gegen Parasiten, die den Darm besiedeln, könnte auch die überlieferte Beobachtung von Leonardo Da Vinci erklären, der beobachtet haben soll, wie sich Wildschweine (Sus scrofa) durch den Genuss von Efeu kuriert haben sollen. Allerdings sind auch andere aus der traditionellen Tierheilkunde bekannte Einsatzmöglichkeiten denkbar.[10] In der traditionellen Tiermedizin wird Efeu bei Verstopfung und Problemen, die nach der Geburt auftreten, eingesetzt.[19]

Von Wildschweinen wird berichtet, dass sie Efeu fressen, um sich selber zu heilen. Fotos: M. Neitzke
Auch die Entdeckung einer schneckenabtötenden Wirkung eröffnen neue Perspektiven bei der Bekämpfung parasitenübertragender Schnecken.[32]
Botanische Besonderheiten des Efeus
Efeu - eine Ausnahmeerscheinung unserer mitteleuropäischen Pflanzenwelt
Efeu (Hedera helix) stellt eine Ausnahmeerscheinung unserer mitteleuropäischen Pflanzenwelt dar. So sind für die in Mitteleuropa herrschenden klimatischen Verhältnisse, die durch einen mehr oder weniger strengen Winter mit Frösten gekennzeichnet sind, laubwerfende Bäume und Sträucher charakteristisch. Der Laubabwurf im Winter stellt eine Anpassung an dieses Klimaregime dar. Efeu dagegen ist immergrün. Zusammen mit dem Ilex (Ilex aquifolium) und der Berberitze (Berberis vulgaris) gehört er zu den wenigen immergrünen Laubgehölzen unserer Pflanzenwelt. In Wäldern, die von laubwerfenden Arten dominiert werden, macht ihn das bei Futterknappheit zu einem wichtigen Winterfutter für unsere einheimischen Pflanzenfresser, wie Rehe und Hirsche.[4, 26, 27,57, 60, 70, 85, 88] Aber auch für ihre Haustiere sammelten Menschen Efeu als Winterfutter. Obwohl Efeu für den Menschen und manche Tiere, z.B. Pferde, Hunde, Katzen giftig ist, scheint er als Winterfutter, solange er nicht im Überfluss gefüttert wurde, für Kühe, Schafe und Ziegen geeignet gewesen zu sein.
Eine weitere besondere Eigenschaft des Efeus ist seine Fähigkeit mit Hilfe von Wurzeln, die er unter günstigen klimatischen Bedingungen an seinen Sprossen ausbildet, an Bäumen oder anderen senkrechten Stützen, wie z.B. Felswänden oder Mauern emporzuwachsen.

Efeu kann mit Hilfe von Wurzeln an seinen Sprossen bis in die Spitzen eines Baumes hinaufwachsen. Er bildet dabei ein dichtes Geflecht aus Trieben, Blättern und Blütenzweigen um den Trägerbaum herum aus (links). Rechts: Kletternder Efeuzweig an einem Baumstamm einer Buche (Fagus sylvatica L.). Fotos: M. Neitzke
Der Efeu ist allerdings kein Schmarotzer, der mit seinen Wurzeln in die Trägerpflanze eindringt und dieser Wasser und Nährstoffe entzieht. Die an der lichtabgewandten Seite der Sprosse ausgebildeten Wurzeln dienen als Kletterwurzeln, die für die Haftung des Sprosses auf der Unterlage sorgen. Man spricht daher auch von Haftwurzeln. In dem Wurzelsystem des Efeus finden wir also eine Arbeitsteilung in Nährstoff- und Wasseraufnahme einerseits und dem Klettern und Haften auf einer Trägerpflanze andererseits. Während die im Boden steckenden Wurzeln für die Wasser- und Nährstoffaufnahme zuständig sind, dienen die an den Sprossen ausgebildeten Luftwurzeln nur zur Befestigung der Pflanze auf dem Substrat. Der Efeu ist damit der einzige in Mitteluropa einheimische Wurzelkletterer.

Efeu bildet am Spross sog. Luftwurzeln aus, die als Kletterwurzeln fungieren. Auf geeignetem Untergrund, wie hier einem Baumstamm, sorgen sie für die Haftung auf dem Substrat. Man spricht daher auch von Haftwurzeln. Foto: M. Neitzke
Die Wurzeln entstehen in der Regel auf der lichtabgewandten Seite an den Sproßabschnitten zwischen den Knoten (Ansatzstellen der Blätter). Da die Wurzeln am Spross gebildet werden bezeichnet man diese als sprossbürtige Wurzeln oder Adventivwurzeln.
Diese Kletterwurzeln müssen unglaublich starke Haftkräfte entwickeln, um es den Pflanzen zu ermöglichen bis in die Wipfel ihrer Trägerpflanzen empor zu wachsen, ohne sich unter dem enormen Gewicht der Blätter, Zweige und Blüten von der Unterlage zu lösen. Die Untersuchung der diesem Phänomen zu Grunde liegenden Mechanismen eröffnet weitere, bisher ungeahnte Einsatzmöglichkeiten des Efeus in der Körperpflege und Medizin.
Bereits Charles Darwin hatte beobachtet, daß die feinen Haftwurzeln (Adventivwurzeln) des Efeus einen gelblichen Schleim ausscheiden, der die Fähigkeit dieser Pflanze an vertikalen Unterlagen emporzuklettern, fördert. Es mussten aber 130 Jahre vergehen, ehe es Forschern aus den USA gelang, mit modernen Untersuchungsmethoden den Mechanismus dieses Sekrets, das wie ein „Superkleber“ wirkt, zu entschlüsseln.[37, 38, 39, 50,110] Es ist die einzigartige Zusammensetzung dieses Sekrets, das die Efeupflanzen zu den beeindruckenden Kletterleistungen befähigt. Zhang und seine Kollegen (2008) fanden heraus, dass dieses Sekret, aus einer Vielzahl von winzig kleinen Teilchen sog. Nanopartikeln besteht, deren Hauptbestandteil bestimmte Kohlenhydratprotein-Verbindungen (Arabiongalactanproteine (AGPs)) sind. Dieses Sekret ermöglicht den Efeupflanzen aber nicht nur unglaublich starke Haftkräfte zu entwickeln, wenn es darum geht senkrecht an Baumstämmen, Felsen oder Mauern emporzuwachsen, sondern es schützt die Wurzeln auch vor UV-Licht. Die Wissenschaftler entdeckten, dass die in dem Sekret vorliegenden Nanopartikel eine starke Auslöschung von UV-Strahlung im Bereich von 200 bis 400 nm zeigen (Li et al. 2010). Diese Nanopartikel können UV-Strahlung bis zu 4 mal so gut abhalten, wie die bisher häufig in Sonnenschutzprodukten eingesetzten Metalloxidnanopartikel (Titanoxid, Zinkoxid), deren gesundheitliche Unbedenklichkeit umstritten ist. Als mögliche Anwendungen in der Medizin werden der Einsatz als Nanocarrier für die zielgerichtete Einschleusung von Chemotherapeutika während einer Krebstherapie oder als Gerüstsubstanz bei Geweberekonstruktionen diskutiert. Auch die Entwicklung neuer Klebstoffe auf Basis des Efeusekrets sind denkbar.
Ungewöhnlich für unsere mitteleuropäische Flora ist auch die Bildung von zwei sehr unterschiedlichen Blattformen in Abhängigkeit von dem Alter und dem Entwicklungszustand der Pflanze. An nicht blühenden, jungen Trieben findet man Blätter, die mehrfach (häufig 3-5 mal) tief eingeschnitten sind, sog. mehrlappige Blätter, mit einer meist auffälligen weißen Aderung. An den blühenden Trieben der erwachsenen Pflanzen werden dagegen einfache, länglich-ovale bis rhombische Blätter gebildet. Neben dem Alter spielt auch wohl das Lichtangebot eine wichtige Rolle.
Für die Herstellung der in der Phytotherapie eingesetzten Präparate werden die 3- bis 5eckig gelappten Blätter nicht blühender Sprosse verwendet, die im Frühjahr bis Frühsommer aus dem unteren Bereich der Pflanze gesammelt werden. Die Anfertigung homöopathische Zubereitungen erfolgt auf der Basis der frischen unverholzten Sprosse. Bei der Produktion von Körperpflegemitteln kommen Extrakte aus Blättern und aus den Sprossen zur Anwendung. Die gesammelten Pflanzenteile stammen aus Wildbeständen.

Deutlich ist die allmähliche Veränderung der Blattform mit zunehmendem Alter und zunehmender Höhe bei dem an einem Kiefernstamm emporkletternden Efeu zu erkennen. Fotos: M: Neitzke
Endgültig zu einem Außenseiter in unserer mitteleuropäischen Pflanzenwelt machen den Efeu neben seinem immergrünen Erscheinungsbild die Verschiedenblättrigkeit (Blattdimorphismus, Heterophyllie), die Ausbildung von Kletterwurzeln und sein für unsere Breiten ungewöhnlicher Lebenszyklus. Der Efeu blüht erst im Herbst, wenn der größte Teil der einheimischen Blütenpflanzen bereits verblüht oder im Abblühen begriffen ist.

Der Efeu ist das einzige einheimische Gehölz, das erst im Herbst blüht. Dadurch bietet er vielen Insekten zu einer Zeit ein reiches Nektar- und Pollenangebot, zu der der größte Teil der einheimischen Blütenpflanzen bereits verblüht oder im Abblühen begriffen ist. Foto M. Neitzke
Die Blütezeit beginnt meist erst im September und kann sich bis in den Oktober oder sogar November erstrecken. Der Efeu ist das einzige einheimische Gehölz mit diesem Blühverhalten. Für zahlreiche Insekten bietet der Efeu dadurch vor dem Winter eine reichliche Nektar- und Pollenmahlzeit und ermöglicht einen hohen Artenreichtum.

Der Efeu wird im Herbst von einer Vielzahl von Insekten als Nahrungsquelle genutzt. Fotos: M. Neitzke

Die Blüten stehen beim Efeu nicht einzeln, sondern in einem Blütenstand, der als einfache Dolde bezeichnet wird. Sein Kennzeichen ist, dass alle Blütenstiele an derselben Stelle ansetzten. Foto M. Neitzke

In einer Dolde blühen die Blüte nicht alle zu demselben Zeitpunkt auf, sondern zeitlich nacheinander. Während sich die im Inneren der Dolde stehenden Blüten noch im Knospenstadium befinden, können die Blüten im unteren äußeren Bereich der Dolde bereits voll aufgeblüht sein.

In einer Dolde blühen die Blüte nicht alle zu demselben Zeitpunkt auf, sondern zeitlich gestaffelt. Die äußeren Blüten blühen zuerst auf. Foto M. Neitzke
Diese Erscheinung finden wir jedoch nicht nur innerhalb einer Dolde, sondern auch zwischen den Dolden. Die einzelnen Dolden sind nämlich ähnlich den russischen Matroschka-Puppen wiederum in einem anderen Blütenstandstyp, der sog. Traube angeordnet.

Die einzelnen Dolden sind ähnlich den russischen Matroschka-Puppen wiederum in einem anderen Blütenstandstyp, der sog. Traube angeordnet. Die Traube ist als ein Blütenstand mit durchgehender Hauptachse definiert, von der die gestielten Blüten, im Fall des Efeus die gestielten Dolden abgehen. Foto: M. Neitzke
Die Traube ist als ein Blütenstand mit durchgehender Hauptachse, von der die gestielten Blüten, im Fall des Efeus die gestielten Dolden abgehen. In der Traube erblühen die Seitendolden deutlich später als die Enddolde. Pro Blütenstand kann so eine Blühdauer von mehreren Wochen erreicht werden.

In dem traubigen Gesamtblütenstand blühen nicht alle Dolden gleichzeitig. Foto: M. Neitzke
Die Früchte, die sich im Herbst bilden, überwintern im unreifen Zustand und reifen erst im folgenden Frühjahr aus. Zu einem Zeitpunkt, zu dem die meisten Früchte unserer einheimischen Pflanzen bereits abgeerntet sind, stellen die schwarz bläulichen Beeren für zahlreiche Vogelarten eine willkommene Nahrungsquelle dar.[80]

Mit Eiskristallen überzogene Früchte des Efeus. Die Früchte des Efeus überdauern den Winter. Die ausgereiften Früchte stellen im Frühjahr eine wichtige Nahrungsquelle für viele unserer Vogelarten dar. Foto: M. Neitzke

Die Früchte des Efeus werden gerne von der Singdrossel (Turdus philomelos) und der Amsel (Turdus merula) gefressen. Fotos M. Neitzke
Die Gründe für dieses ungewöhnliche Blüh- und Fruchtverhalten, das nicht im Einklang mit dem mitteleuropäischen Klima steht, sondern eher jenem von tropisch-subtropischen Pflanzen ähnelt, ist in seiner Vergangenheit zu suchen.[47]
Hedera helix gehört zu den Vertretern der Pflanzenwelt, die für die Vegetation des Tertiärs in Europa typisch war und denen es gelang den Kälteeinbruch der Eiszeit und die damit verbundene Auslöschung dieser Vegetation in klimatisch günstigeren Regionen zu überdauern. Im Tertiär war das Klima in Europa viel wärmer als heute. Es herrschten tropische oder subtropische Verhältnisse und die klimatischen Bedingungen veränderten sich viele Millionen Jahre lang nur unwesentlich. Fast ganz Europa war von Lorbeerwäldern bedeckt, die durch wärmebedürftige und feuchtigkeitsliebende, immergrüne sog. laurophylle (von lat. = laur= Lorbeer und gr. Phyllos = Blatt) Arten gekennzeichnet waren. In diesen Wäldern, von denen es heute nur noch Reste auf den Kanaren und Madeira gibt, wuchs die Gattung Hedera. Extreme Klimaveränderungen leiteten schließlich die Eiszeit des Quartärs ein. Mit dem Einsetzen der Eiszeiten wurde die Pflanzenwelt der tertiären Lorbeerwälder größtenteils verdrängt und zerstört. Der Efeu hat die letzte Eiszeit wohl in drei Refugien überdauert, nämlich SO-Spanien, dem Balkan und dem südlichen Alpenraum. Nach einer erneuten Klimaänderung konnte sich die Gattung von dort aus über ganz Europa verbreiten. Seine Eigenschaften, die aus einer Anpassung an ein Leben in einem tropischen Lorbeerwald resultierten hat er beibehalten. Er wird daher als Tertiärrelikt bezeichnet. Seine heutige Verbreitung erreichte der Efeu nach der nacheiszeitlichen (postglazialen) Wiederbesiedlung von der Zeit zwischen 8690 und 7270 v. Chr. in der Nacheiszeit (Boreal).
Efeu (Hedera helix) - Blütenaufbau und Insektenbesuch
Um die Attraktivität einer Efeublüte für die vielen Blütenbesucher zu verstehen, müssen wir uns eine einzelne Blüte genauer ansehen.
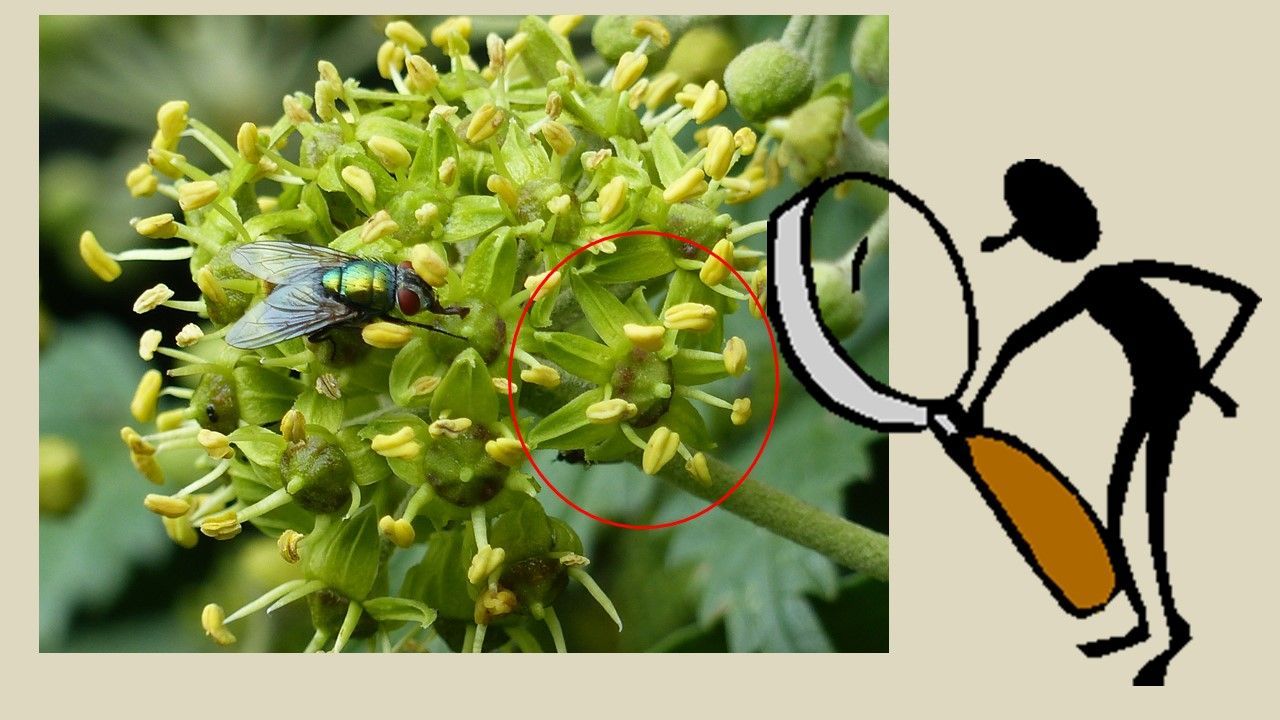
Schauen wir uns eine einzelne Blüte des Efeus von oben ab, so sehen wir, dass sie den typischen Aufbau einer Blütenpflanze aufweist:

Wir haben 5 gleich große, grünlich gelbe Blütenkronblätter, die in einem Kreis um den Fruchtknoten herum angeordnet sind. Die 5 sehr kleinen Kelchblätter sind in der Aufsicht nicht zu erkennen.
In der Lücke zwischen den Kronblättern stehen jeweils die Staubblätter, also jeweils 5 in jeder Blüte. Die Staubblätter stellen die männlichen Geschlechtsorgane einer Blüte dar. Ein Staubblatt besteht aus einem Stiel, dem Staubfaden und den Staubbeuteln. In den Staubbeuteln werden die männlichen Fortpflanzungszellen, der Pollen („Blütenstaub“) produziert. Der Pollen wird von zahlreichen Insekten, wie Bienen und Hummeln gesammelt oder an Ort und Stelle verzehrt. Pollen ist ein sehr hochwertiges Nahrungsmittel für Insekten. Er enthält Fett, Eiweiß, Zucker, Mineralstoffe und viele Vitamine.

Eine Honigbiene (Apis mellifera) sammelt den gelben Pollen für ihre Brut und transportiert ihn in den gelben Höschen zum Stock. Foto: M. Neitzke

Zahlreiche andere Insekten, wie die Gemeine Sumpfschwebfliege (Helophilus pendulus), fressen den Pollen aus den sich bei Reife öffnenden Staubbeuteln selber. Foto: M. Neitzke
In der Mitte der Blüte und des Fruchtknotens stehen die zu einer Säule verwachsenen 5 Griffel mit der Narbe.
Bei genauer Betrachtung des Fruchtknotens, scheint die ganze Oberfläche des Fruchtknotens - von der Basis der Griffel bis zur der Ansatzstelle der Staubbeutel und Blütenkronblätter – von einer glitzernden, ungleichmäßig strukturierten Schicht überzogen zu sein. Diese erfreut sich bei allen Insekten, die die Efeublüten besuchen, einer großen Beliebtheit und wird unabhängig von der Rüssellänge eifrig abgeleckt. Es handelt sich hierbei um eine Vielzahl von winzigen Nektartröpfchen, die von einem Drüsengewebe auf der Oberfläche des Fruchtknotens abgegeben werden.

Insekten mit sehr unterschiedlicher Rüssellänge können die glänzende Oberfläche des Fruchtknotens einer Efeublüte ablecken. Der Admiral besitzt mit 13-14 mm den längsten Rüssel. Die Goldfliege (Lucilia spec.) mit 3 mm den kürzesten (links). Die Mistbiene (Eristalis tenax) nimmt mit 7-8 mm eine mittlere Position ein (Mitte). Fotos: M. Neitzke

Schauen wir uns die glitzernde Oberfläche des Fruchtknotens genauer an, so sieht man, dass bei manchen Blüten die Oberfläche des Fruchtknotens sogar mit einer weißen kristallinen Schicht bedeckt ist. Es handelt sich hierbei um auskristallisierten Nektar. Foto: M: Neitzke
Aber woher kommt der Nektar der sich in so großen Mengen, auf der Oberfläche des Fruchtknotens befindet?
Um dieser Frage nachzugehen, machen wir einen Längsschnitt durch eine Blüte.

Auf der Abbildung sieht man den rautenförmigen Fruchtknoten, der im unteren Teil bis zur Hälfte mit dem Blütenboden verwachsen ist. Die obere Hälfte liegt frei. An dessen Oberfläche erkennen wir die glitzernde, ungleichmäßig strukturierte Schicht aus Nektartröpfchen wieder, die uns schon in der Aufsicht der Blüten aufgefallen war. Foto: M. Neitzke
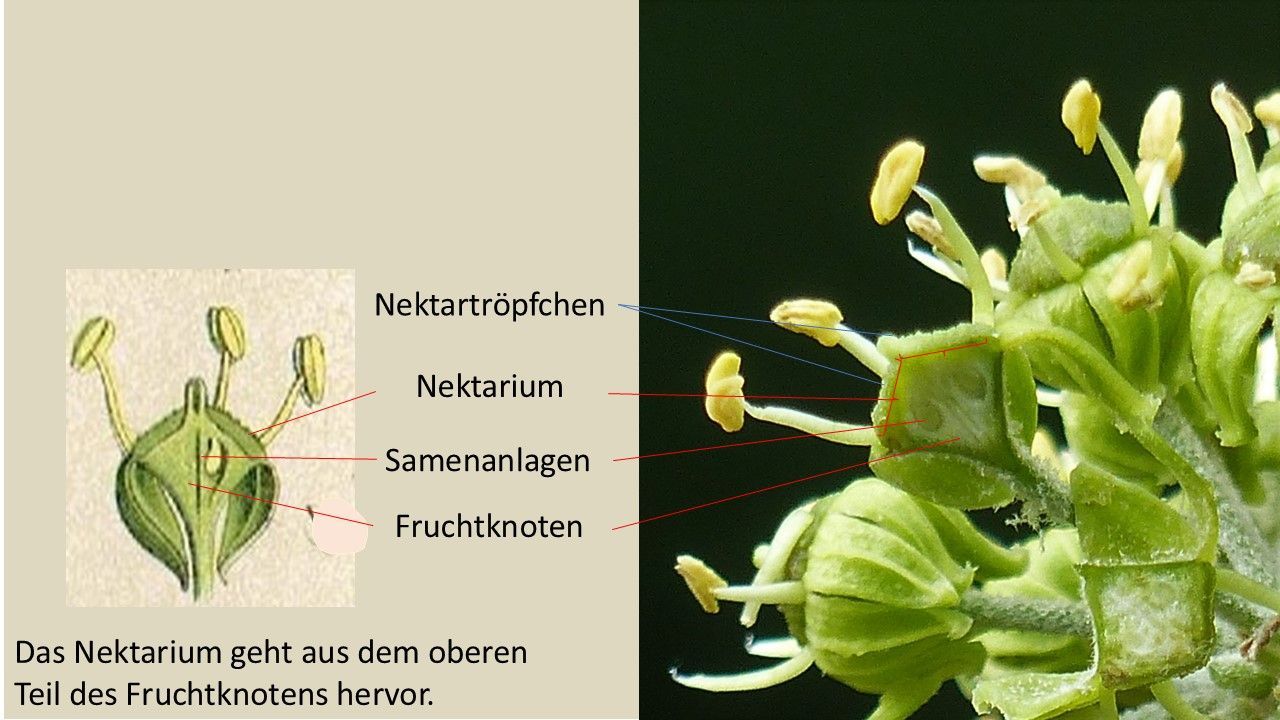
Eine Zeichnung (Lindman (1901-1905)) zeigt noch einmal deutlich, wie sich, ähnlich einer Kuppel über dem Fruchtknoten ein scheibenförmiges, zusammenhängendes Drüsengewebe ausbreitet, das den Nektar absondert. Aufgrund seiner Funktion - Nektarproduktion und Nektarabsonderung - wird es als Nektarium bezeichnet.

Das etwa 1mm dicke und 4 mm breite Nektarium des Efeus (links) wird wegen seiner Form auch als Drüsenscheibe, Griffelpolster oder Diskus bezeichnet wird. Es erstreckt sich von der Ansatzstelle der Staubblätter bis zur Basis des Griffels. Entscheidend ist, dass der Nektar offen dargeboten wird.
Ganz anders sind die Verhältnisse z.B. beim Lungenkraut (rechts). Hier ist der Nektar auf dem Grund der langen Blütenkronröhre verborgen. Man kann den Fruchtknoten mit dem ihn umgebenden Nektardiskus nur sehen, wenn man wie an der vorderen Blüte, die Krone und den Kelch entfernt.
Und jetzt kommt die Rüssellänge der Insekten ins Spiel. Zwischen den Arten der verschiedenen Insektenordnungen, der Familien innerhalb einer Ordnung, den Gattungen in einer Familie und den Arten innerhalb einer Gattung bestehen beträchtliche Unterschiede hinsichtlich der Rüssellänge und damit der Möglichkeit an den Nektar in den sehr unterschiedlich gebauten Blüten heranzukommen. An den offen dargebotenen Nektar der Efeublüte können sowohl Insekten mit sehr kurzen Rüsseln, wie die meisten Fliegen und Wespen als auch Insekten mit langen Rüsseln, wie z.B. Schmetterlinge. An den in der Blütenkrone verborgenen Nektar des Lungenkrauts gelangen nur Insekten mit entsprechend langem Rüssel. Die Anzahl dieser Insekten ist beschränkt. Der offen dargebotene Nektar der Efeublüte ermöglicht es vielen Insekten mit sehr unterschiedlichen Rüssellängen den Nektar zu nutzen. Dies ist einer der Gründe für die hohe Artendiversität der Insekten, die wir am Efeu beobachten.

Die Rüssellänge variiert zwischen den verschiedenen Insekten beträchtlich. Die größte Variationsbreite und die längsten Rüssel finden wir bei den Schmetterlingen. Fliegen haben dagegen nur sehr kurze Rüssel. Seine Länge variiert in den Familien kaum. Fotos: M. Neitzke

Viele Schmetterlinge unterscheiden sich in der Rüssellänge. Bei den dargestellten Arten reicht die Spanne von 7 mm bei Gewöhnlichen Wiesenvögelchen (Coenonympha pamphilus) bis zu 17-18 mm beim Tagpfauenauge (Inachis io), dem Zitronenfalter (Gonepteryx rhamni) und dem Kleinen Kohlweißling (Pieris rapae). Fotos: M. Neitzke

Die Vertreter der Ordnung der Hautflügler unterscheiden sich ebenfalls deutlich in ihrer Rüssellänge. Während die Hornisse und die verschiedenen Wespenarten nur wenige mm lange Rüssel haben und daher auf Blüten mit offen dargebotenem Nektar, wie die Efeublüte angewiesen sind, können die Hummelarten mit ihren relativ langen Rüsseln auch den Nektar erreichen, der tief in den Blüten verborgen ist. Fotos: M. Neitzke

Innerhalb der riesigen Ordnung der Zweiflügler (Diptera) mit nahezu 100000 bekannten Arten, sind es verhältnismäßig wenig Familien, deren Arten regelmäßig Blüten besuchen. Entsprechend der großen Spannweite bzgl. der Rüssellänge von 1 mm bis 10 mm, werden sehr viele Pflanzenfamilien von Arten der Zweiflügler besucht. Die kurzrüsseligen sind auf Blüten mit leicht zugänglichem Nektar, wir die Efeublüten angewiesen. Fotos: M. Neitzke

Die bekanntesten Blütenbesucher unter den Zweiflüglern sind die Schwebfliegen. Ihre Größe schwankt zwischen 4 mm und 18-19 mm. Entsprechend groß sind die Unterschiede in der Rüsselläge zwischen den Arten. Fotos: M. Neitzke

Der offen dargebotene Nektar einer Efeublüte kann auch von Insekten mit einem kurzen Rüssel genutzt werden. Der tief unten in der Kronröhre verborgene Nektar in einer Blüte des Lungenkrauts (Pulmonaria officinalis) ist nur für Insekten mit langem Rüssel, wie beispielsweise dem Wollschweber (oben, Rüssellänge: 10 mm) und der Ackerhummel (unten, Rüssellänge: 14-16 mm) zugänglich. Fotos: M. Neitzke

Während sich die Insekten nektarschlürfend von Blüte zu Blüte bewegen streifen die Staubbeutel, ähnlich den Bürsten bei der Unterbodenwäsche in der Autowaschanlage, über den behaarten Körper und die Beine der Insekten. Der Pollen bleibt dabei in den Haaren hängen und kann bei dem nächsten Blütenbesuch auf einer empfängnisbereiten Narbe abgeladen werden. Fotos: M. Neitzke
Efeu als Quelle für Biodiversität und Nutznießer der Tiervielfalt
Efeu bietet Nahrung für eine Vielzahl von Insekten, die eine Reihe wichtiger Funktionen im Naturhaushalt erfüllen. Auffallend ist die hohe Zahl an Blütenbesuchern an den unscheinbaren kleinen Blüten des Efeus im Herbst. Dies betrifft sowohl die hohe Artenvielfalt (Biodiversität) der Blütenbesucher als auch die hohe Anzahl der Vertreter einzelner Arten (Individuendichte). Über 80 verschiedene Insektenarten aus der Ordnung der Schmetterlinge, Hautflügler, Zweiflügler und Käfer wurden bei dem Besuch von Efeublüten beobachtet.[57, 63] An sonnigen Tagen konnten an einem etwa 3 m x 3 m großen blühenden Efeu bis zu 40 verschiedene Insektenarten gleichzeitig beobachtet werden.
Die größten und auffälligsten Blütenbesucher sind die Schmetterlinge. In besonders hoher Zahl ist unter günstigen Bedingungen der Admiral, das Pfauenauge und der C-Falter beim Nektarsaugen an den Efeublüten zu beobachten.

Viele Schmetterlinge nutzen das späte Nektarangebot des Efeus, darunter auch der Buchsbaumzünsler, ein Kleinschmetterling aus Ostasien, dessen Raupen durch Kahlfraß Schäden an Buchsbäumen verursachen. Fotos: M. Neitzke
Schmetterlinge leisten einen wichtigen Beitrag zur Bestäubung der Efeublüten.

Während die Schmetterlinge nektarschlürfend von Blüte zu Blüte über die Dolde wandern, bleiben die Pollenkörner in dem behaarten Körper hängen und können bei dem nächsten Besuch einer in einem anderen Entwicklungszustand befindlichen Blüte auf die empfängnisbereiten Narben abgeladen werden. (Admiral (Vanessa atalanta), oben links, C-Falter (Polygonia c-album), oben rechts, Tagpfauenauge (Inachis io), unten links, Waldbrettspiel (Pararge aegeria), unten rechts). Fotos: M. Neitzke
Aber auch die Ordnung der Hautflügler (Hymenoptera) ist mit der Honigbiene, der Efeu-Seidenbiene sowie verschiedenen Wespen- und Hummelarten gut vertreten.

Blütenbesucher aus der Ordnung der Hautflügler, sind wichtige Bestäuber des Efeus. (obere Reihe von links nach rechts: Gemeine Wespe (Vespula vulgaris), Honigbiene (Apis mellifera), Hornisse (Vespa crabro), Efeu-Seidenbiene (Colletes hederae), untere Reihe von links nach rechts: Kotwespe (Mellinus arvensis), Dunkle Erdhummel (Bombus terrestris), Baumhummel (Bombus hypnorum), Französische Feldwespe (Polistes dominula). Fotos: M. Neitzke
Die vielfältigste Gruppe an Blütenbesucher stellt mit über 57 belegten Arten aus den Familien der Echten Fliegen, Schmeißfliegen, Dungfliegen, Raupenfliegen und Schwebfliegen die Ordnung der Zweiflügler dar. Die größte Gruppe bilden mit etwa 33 Arten die Schwebfliegen. Die Familie der Schmeißfliegen ist mit 8 Arten deutlich seltener vertreten. Ihnen folgen die Familie der Echten Fliegen und der Igelfliegen mit jeweils 7 Arten. Die Familie der Dickkopffliegen und der Dungfliegen wird jeweils nur durch eine Art repräsentiert.[57, 63]

Die vielfältigste und häufigste Gruppe an Blütenbesucher stellt die Ordnung der Zweiflügler. Vertreter der Schwebfliegen (Syrphidae), der Dickkopffliegen (Conopidae), der Igelfliegen (Tachinidae), der Dungfliegen (Scathophagidae), der Echten Fliegen (Muscidae) und der Schmeißfliegen (Calliphoridae) sind häufige Besucher. Fotos: M. Neitzke
Zu den Zweiflüglern gehört auch die für die Bestäubung so wichtige Familie der Schwebfliegen.

Die Familie der Schwebfliegen ist mit 33 Arten unter den Besuchern der Efeublüten gut vertreten. Die häufigsten Arten sind die Totenkopfschwebfliege (Myathropa florea), die Hornissenschwebfliege (Volucella zonale), die Mistbiene (Eristalis tenax), die Matte Schwarzkopfschwebfliege (Melanostoma scalare) (obere Reihe von links nach rechts), die Große Schwebfliege (Syrphus ribesii), die Sumpfschwebfliege (Helophilus pendulus), die Gemeine Keilfleckschwebfliege (Eristalis pertinax) und die Mittlere Keilfleckschwebfliege (Eristalis interrupta). Fotos: M. Neitzke
Diese hohe Besucherzahl ist, wie bereits in den vorangegangenen Kapiteln erläutert wurde, zum einen auf den Bau der Efeublüten und zum anderen auf den Blühzeitpunkt zurückzuführen. Efeu beginnt meist erst im September zu blühen. Zu einem Zeitpunkt zu dem der größte Teil der einheimischen Blütenpflanzen bereits schon verblüht oder im Abblühen begriffen ist, bietet er ein reiches Nektar- und Pollenangebot. Durch einen gestaffelten Blühbeginn der zahlreichen Blüten einer Dolde aber auch der einzelnen Dolden in dem gesamten traubigen Blütenstand wird das Nektarangebot über einen relativ langen Zeitraum für die Insekten bereitgehalten. Die Blütezeit kann bis in den Oktober oder sogar November hineinreichen.
Aber nicht nur die Insekten profitieren von dem Efeu, auch der Efeu profitiert von dem Besuch der zahlreichen Insekten, da diese die Bestäubung seiner Blüten vollziehen. Ein Ausschluss der Insektenbestäubung führt zu einer starken Reduktion des Fruchtansatzes.[41] Für viele von ihnen ist aber die Bestäubungstätigkeit nicht die einzige wichtige Aufgabe, die sie im Naturhaushalt erfüllen und von deren Bewältigung wir Menschen profitieren. Sowohl die erwachsenen Tiere als auch die Larvenstadien vieler Insektenartenspielen spielen, je nach Ernährungsweise, als natürliche Schädlingsbekämpfer oder im Stoffkreislauf durch den Abbau von faulendem Pflanzenmaterial, dem Verwerten von Aas oder Exkrementen eine wichtige Rolle.[67]

Für viele Insekten, die als biologische Schädlingsbekämpfer eine wichtige Rolle spielen, stellt der Efeu eine willkommene, späte Nektar- und Pollenquelle dar. Fotos: M. Neitzke
Während die Rolle des Marienkäfers (Coccinella septempunctata), einem häufigen Besucher der Efeublüten, beim Vertilgen von Blattläusen und damit der biologischen Schädlingsbekämpfung den meisten von uns bekannt ist, ist dies für andere Arten, wie den Schwebfliegen, Wespen und Hornissen nicht der Fall. Der Appetit, den sie dabei entwickeln ist aber durchaus mit dem des Marienkäfers zu vergleichen. So fressen die Larven der Großen Schwebfliege und ein erwachsener Marienkäfer etwa 100-150 Blattläuse pro Tag, die Larve der Hainschwebfliege geschätzte 80 Blattläuse/Tag. Ihre mehrere hundert Eier legt die Hain- oder Winterschwebfliege gezielt unmittelbar an Blattlauskolonien, so dass die madenartigen Larven einen reich gedeckten Tisch vorfinden. Die Larven von rund 100 der 450 einheimischen Schwebfliegenarten haben sich auf das Vertilgen von Blattläusen spezialisiert.[101, 102, 105, 106]
Auch die Rolle der Wespen und Hornissen, die zu den regelmäßigen Besuchern der Efeublüten im Herbst gehören, wird oft unterschätzt. Während sich die erwachsenen Tiere der Wespen vorwiegend vegetarisch (Nektar, Pollen Pflanzensäfte Honigtau der Blattläuse) ernähren, erfolgt die Ernährung der Brut ausschließlich mit tierischer Kost. Um ihre Brut mit dem notwendigen tierischen Eiweiß zu versorgen, jagen Wespen und Hornissen beträchtliche Mengen an Insekten wie Bremsen, Mücken und Fliegen. Ein durchschnittlich großes Hornissenvolk fängt ungefähr 500 g Insekten/Tag, ein Volk der Gemeinen Wespe 500-1000 Insekten/Tag. Die Hornissen sammeln gern die Raupen des Eichenwicklers (Tortrix viridana) oder der Gemeinen Kiefernbuschhornblattwespe (Diprion pini) von befallenen Bäumen ab und machen sich damit auch im Forstschutz nützlich.[103, 104]
Neben der Bestäubung von Pflanzen und dem Vertilgen von Unmengen an Insekten beteiligen sich Wespen auch als „Gesundheitspolizei“ beim Verwerten von toten Tieren. Besonders die Deutsche und die Gemeine Wespe, also jene Arten, die dem Menschen lästig werden können, nehmen auch Aas an. Gerade in der Beseitigung von Aas kommt den beiden Wespenarten in unseren besiedelten Bereichen eine wichtige Aufgabe zu.
Vielen Insektenarten, die als Eier oder Larven den Winter überdauern, stellt der Efeu den erwachsenen Tieren, die im Herbst sterben, eine letzte wohlverdiente Mahlzeit bereit, anderen dagegen, die im Herbst in den Süden ziehen oder auch solchen, die als erwachsene Tiere überwintern (wie z.B. Königinnen verschiedener Wespen- und Wildbienenarten, Hornissen, manche Tagfalter und Käferarten) bietet der Efeu die Möglichkeit die notwendige Energie zu tanken. Zu den Wanderfaltern, die im Herbst, den Zugvögeln ähnlich, über die Alpen in den Süden bis nach Nordafrika ziehen gehören der Admiral und der Distelfalter. Im Mai des darauffolgenden Jahres wandern sie aus dem Mittelmeerraum wieder bei uns ein. Vor allem der Admiral nutzt den Efeu als eine Art „Tankstelle“, um sich für den Flug nach Süden mit ausreichend Energie zu versorgen. Auch für das Tagpfauenauge und den C-Falter, die als erwachsene Tiere überwintern, stellt der Efeu eine wichtige Nektarquelle dar, bevor sie in eine Winterruhe fallen.

Der Distelfalter (Vanessa cardui) (auf den Blüten des Wasserdostes (Eupatorium cannabinum)) gehört zu den Wanderschmetterlingen. Fotos: M. Neitzke

Der Admiral (Vanessa atalanta) nutzt den Efeu als „Tankstelle“ bevor zu seinem anstrengenden Flug in den Süden aufbricht. Fotos: M. Neitzke
Schmetterlinge sind aber nicht die einzigen Insekten, die ähnlich den Zugvögeln im Herbst gen Süden wandern. Auch unter den Schwebfliegen, eine in ihrer Bedeutung als Bestäuber noch häufig unterschätzten Gruppe, gibt es wandernde Arten.

Zu den wandernden Schwebfliegen gehören die Mistbiene (Eristalis tenax, oben links), die Hainschwebfliege (Episyrphus balteatus, oben rechts), die Gemeine Sumpfschwebfliege (Heliophilus pendulus, unten links) und die Große Schwebfliege (Syrphus ribesii, unten rechts). Fotos: M. Neitzke
Ihre gerichteten saisonale Wanderungen führen im Herbst von Mitteleuropa nach Süden und Südwesten in die Mittelmeerregion. Die Tiere durchqueren dabei die Pässe der Mittelgebirge, der Pyrenäen und der Alpen (so etwa den Col de Bretolet in den Walliser Alpen). Sie weisen dabei ein ähnliches Verhalten auf wie ziehende Tagfalter und Vögel. Auf der Forschungsstation Randecker Maar auf der Schwäbischen Alb wurden ab 1970 neben dem Vogelzug auch wandernde Insekten im Sommer und Herbst auf ihrem Weg nach Süden quantitativ erfasst. Hier wird der südwärts gerichtete Zug durch einen Gebirgspass horizontal und vertikal gebündelt. Die Ergebnisse in einer 2020 veröffentlichten Studie sind alarmierend.[24] Die Forscher beobachteten bei den für die Bestäubung so wichtigen Schwebfliegen einen Rückgang bis zu 97 %. Bei den für die biologische Schädlingsbekämpfung bedeutsamen Arten, die sich während ihrer Larvenentwicklung von anderen Insekten bzw. deren Larven (zoophage Ernährung) bzw. insbesondere Blattläusen ernähren (aphidophage Larvenentwicklung) wurde ein Rückgang auf etwa 10 % festgestellt.
Ähnlich dramatisch ist der Rückgang bei anderen wandernden Insektengruppen, wie den Waffenfliegen (Rückgang auf 16 %) und den Schlupfwespen (Rückgang auf 14 %). Diese Untersuchung bestätigt somit den Trend, den auch zahlreiche anderen Untersuchungen bzgl. des Rückgangs der Biomasse und der Diversität der Insekten festgestellt haben. Ursache für den starken Insektenrückgang ist sowohl die Abnahme der Qualität als auch der Quantität ihrer Lebensräume.
Zu den Nutznießern des späten Nektar- und Pollenangebotes gehört auch unsere Honigbiene. Für sie leisten die Efeublüten, einen wichtigen Beitrag zur sogenannten „Herbstaufbautracht“ (15. Juli bis 15. Oktober).[31] Für die Wildbienen ist Efeu wegen seiner späten Blütezeit (September bis Oktober) als Futterquelle fast zu vernachlässigen.[95] Es liegen nur vereinzelte Beobachtungen über den Besuch von Wildbienen an Efeublüten vor. Eine Ausnahme ist die Efeu-Seidenbiene (Colletes hederae), die Efeu deutlich bevorzugt. Während sich die Flugzeit für die meisten Wildbienenarten im September dem Ende nähert, beginnt sie für die Efeu-Seidenbiene erst im Spätsommer. Die Efeu-Seidenbiene erscheint erst Ende August, wenn der Efeu ihre Hauptpollenquelle zu blühen beginnt. Sie ist somit in Mitteleuropa die Wildbienenart, die am spätesten fliegt. Die Weibchen beginnen erst im September zu nisten.

Die Efeu-Seidenbiene (Colletes hederae) nutzt als eine der wenigen Wildbienen das Nektarangebot des Efeus. Foto: M. Neitzke
Die Arten mit dem skurrilsten Aussehen kommen eindeutig aus der Ordnung der Zweiflügler (Dipteren). Der für den Menschen unangenehme etwas faulige, süßliche Amingeruch der Efeublüten scheint vor allem für Vertreter der verschiedenen Fliegenfamilien unwiderstehlich zu sein. Wegen ihrer geringen Größe werden sie häufig übersehen und auch die Schwierigkeiten beim Bestimmen der Arten führt dazu, dass sie häufig bei Artenerhebungen unterrepräsentiert sind. Ihrer Rolle im Naturhaushalt wird man mit dieser Geringachtung aber nicht im mindesten gerecht.

Die Raupenfliegen (obere Reihe von links nach rechts: Cylindromyia bicolor, Breitflügelige Raupenfliege (Ectophasia crassipennis), Goldschildfliege (Phasia aurigera), Igelfliege (Tachina spec.), untere Reihe von links nach rechts: Dickkopffliege (Conops flavipes), Goldfliege (Lucilia spec.) und Hornissenschwebfliege (Volucella zonaria), zu den Echte Fliegen zählende Gefleckte Hausfliege (Graphomya maculata), Rinderfliege (Mesembrina meridiana). Fotos: M. Neitzke
Sie spielen als Bestäuber eine große Rolle und sind wichtige Glieder in verschiedenen Nahrungsketten. So nutzen Hornissen, verschiedene Wespenarten und andere Insekten den Efeu nicht nur als Kohlenhydratquelle sondern auch als ergiebiges Jagdrevier, welches sie geschickt untereinander aufgeteilt haben.[103, 104]

Die Blüten des Efeus werden nicht nur als Nektar- und Pollenquelle genutzt. Für einige Insekten, wie die Hornisse (Vespa crabro), die Kotwespe (Mellinus arvensis), die Gelbe Dungfliege (Scatophaga stercoraria) und die Gewöhnliche Strauchschrecke (Pholidoptera griseoaptera) bietet der Efeu auch ergiebige Jagdgründe. Fotos: M. Neitzke
So kontrolliert die Hornisse vor allem den Luftraum über dem Efeu. Hornissen sind geschickte Jägerinnen, die ihre Beute in einem rasanten Sturzflug, meist auf kurze Distanz, angreifen. Sie setzen dabei auf Überrumpelung und Schnelligkeit, indem sie blitzschnell auf ihre potentielle Beute aus der Luft herabstoßen. Diese Jagdmethode hat ihnen den Spitznamen „Falke unter den Insekten“ eingetragen. Im freien Flug können Hornissen im Durchschnitt Geschwindigkeiten von 20-42 km/h (6m/s) erreichen. Während des Sturzfluges bei einem Angriff auf ein Beutetier dürften kurzzeitig sogar noch höhere Spitzengeschwindigkeiten erreicht werden.

Die Hornisse kontrolliert den Luftraum über dem Efeu (links). Sie war bei der Jagd erfolgreich und hat eine Gemeine Wespe erbeutet. Fotos: M. Neitzke

Auch Honigbienen gehören zum Beutespektrum der Hornissen. Fotos: M. Neitzke

Andere Jäger, wie die Kotwespe (Mellinus arvensis) oder die Gelbe Dungfliege (Scatophaga stercoraria) lauern ihrer Beute im Innern eines Efeubusches auf. Auch in Bezug auf das Beutespektrum unterscheiden sich die Jäger, die den Efeu als Jagdrevier nutzen. Während die Hornisse vorwiegend Wespen aber auch Bienen jagt, hat es die deutlich kleinere Kotwespe auf verschiedene Fliegenarten, v.a. aus den Familien der Schmeißfliegen und Echten Fliegen abgesehen. Da letztere sich gerne in der Nähe von Kothaufen und Kuhfladen aufhalten, gehören diese ebenfalls mit zu ihren bevorzugten Jagdrevieren. Dieser Tatsache hat sie ihren etwas unappetitlichen Namen „Kotwespe“ zu verdanken.[6] Die Jagd besteht aus einer Kombination aus Anschleichen und Angriffssprung. Die Fliege wird durch einen Stich mit Gift gelähmt. Ist eine Fliege in der Nähe, schleicht sich die Kotwespe an, stürzt sich auf die Fliege und lässt sich mit ihr zu Boden fallen.

Laufend, springend und fliegend bewegt sich die Kotwespe (Mellinus arvensis) durch das Dickicht des Efeus auf der Suche nach Beute. Ihre Umgebung hat sie immer im Blick. Eine aufmerksame Beobachtung der Umgebung ist Voraussetzung für eine erfolgreiche Jagd. Fotos: M. Neitzke

Die Kotwespe hat eine geeignete Beute, eine Goldfliege, auf einer Blütendolde erspäht. Ohne dass die Fliege es bemerkt, kommt sie ihrem Opfer, gefährlich nahe. Nicht einmal eine Doldenweite beträgt der Abstand zwischen Leben und Tod (links). So nimmt das Drama seinen Lauf.
Ein gezielter Sprung ……

…. und die Jägerin landet mit ihrer durch einen Stich gelähmten Beute auf einem tiefer gelegenen Blatt.

Jetzt muss nur noch der Absturz auf dem abschüssigen Landeplatz verhindert werden.

Der Landplatz ist doch sehr abschüssig (links). Ein kräftiger Ruck. Geschafft!!
Jetzt kann die Fliege als Larvennahrung zum Nest transportiert oder von der Jägerin selbst verspeist werden.

Ebenso wichtig wie die Bestäuber für eine hohe genetische Vielfalt und damit das Vorhandensein einer hohen Vielfalt an sekundären Pflanzenstoffen in einer Pflanze verantwortlich sind, sind es aber auch die Pflanzenfresser, die sich von den verschiedenen Pflanzenteilen ernähren. Dabei handelt es sich nicht nur um die großen Säugetiere, wie Rehe, Hirsche oder das Damwild, die den Efeu als Winterfutter nutzen, sondern auch wieder um die vielen kleinen Insekten. Es sind über 76 Insektenarten bekannt, die entweder als Larve, wie die des Efeuwicklers oder als erwachsene Tiere an den Blättern des Efeus fressen.[57] Unter dem Druck der von ihnen lebenden Herbivoren entwickeln die Pflanzen immer neue sekundäre Pflanzenstoffe, um sich die Fressfeinde vom Leibe zu halten. Für die neuen Bauanleitungen der biologisch aktiven Substanzen sorgen die Insekten bei der Bestäubung der Efeupflanzen durch die ständige Durchmischung der Gene. Die einzigartige Mischung an biologisch aktiven Stoffen in einer Pflanze ist also das Ergebnis einer Koevolution zwischen einer Pflanze und ihren Fressfeinden.

Literatur:
- Al-Snafi, A. E. (2018): Pharmacological and therapeutic activities of Hedera helix – A review. IOSR J. Pharm., 8: 41-53.
- Anton, J. G., Puche, J. C., Valles, A. G. & E. Passerine (2007): Composition for the prevention and treatment of cellulitis. U. S. Patent 20070031516, February 8, 2007.
- Asmaa, B.H. & R. Nayal (2016): In vitro screening of the pancreatic cholesterol esterase inhibitory activity of some medicinal plants grown in Syria. IJPPR, Int. J. Pharmacogn. Phytochem., 8: 1432-1436.
- Bartolomé, J. Rosell, C. & E. Bassols (2002): Diet composition of roe deer (Caperolus capreolus) in the natural park of the Ganatxa Volcanic Zone (Catalonia Spain). Pirineos 157. DOI:10.3989/pririneos.2002.v157.61
- Bäumler, S. (2012): Heilpflanzenpraxis heute, Band 1 Arzneipflanzenporträts. 2. Aufl. Urban & Fischer, München, 701 S.
- Bellmann, H. (2017): Bienen Wespen Ameisen. Kosmos-Naturführer, Franckh-Kosmos, Stuttgart, 334 S.
- Bezerra, K. G. O., Rufino, R. D., Luna, J. M. & L.A. Sarubbo (2018): Saponins and microbial biosurfactants: Potential raw materials for the formulation of cosmetics. Biotechno. Prog., 34: 1482-1493.
- Bezruk, I.V., Grudko, V.O., Georgiyants, V.A. & L. Ivanauskas (2020): Screening of the antioxidant activity of extracts from Hedera helix leaves using the HPLC/APTS method. Clin. Pharm., 24: 47-52.
- Bezruk, I.V., Materienko, A., Gebar, S., Proskurina, K., Budanova, L., Ivanauskas, L. & V. A. Georgiyants (2020): Estimation of the influence of the environmental factors on the accumulation of phytochemicals and antioxidant capacity in the ivy leaves (Hedera helix L.). Nat. Prod. Res., 4: 1-6.
- Bulitta, S., Piluzza, G. & L. Viegi (2007): Plant resources used for traditional ethnoveterinary phytotherapy in Sardinia (Italy). Gent. Resour. Crop Ecol., 54: 1447-1464.
- Burlando, B., Verotta, L., Cornara, L. & E. Bottini-Massa (2010): Herbal principles in cosmetics: properties and mechanisms of action. Taylor & Francis Lid. 460 S.
- Chichiriccó, G., Citani, M. P., Frizzi, G. & F. Tammaro (1980): Phytotherapy in the Subequana Valley, Abruzzo, Central Italy. J. Ethnopharmacol., 2: 247-257.
- Chinery, M. (2002): Buch der Insekten, Parey, Berlin, Wien, 3. Aufl. 328 S.
- Cioacá, C. Margineanu, C. & V. Cucu (1978): The saponins of Hedera helix with antibacterial activity. Pharmazie, 33: 609-610.
- Deliorman Orhan, D., Ozçelik, B., Hoşbaş, S. & M. Vural (2012): Assessment of antioxidant, antibacterial, antimycobacterial and antifungal activities of some plants used as folk remedies in Turkey against dermatophyts and yeast-like fungi. Turk. J. Biol., 36: 672-686.
- Dierbach, J. H. (2013): Die Arzneimittel des Hippokrates. Bremen University Press, 300 S.
- Dupont, E., Journet, M., Oula, M.-L., Gomez, J., Léveilé, C., Loing, E. & D. Bilodeau (2014): An integral topical gel for cellulite reduction: results from a double-blind, randomized, placebo-controlled evaluation of efficacy. Investig. Dermatol., 7: 73-78.
- Eguale, T., Tilahun, G., Debell, A. Feleke, A. & E. Makonnen (2007): Haemonchus contortus: in vitro and in vivo anthelmintic activity of aqueous andhydro-alcoholic extracts of Hedera helix. Ex parasitol., 116: 340-345.
- Erarslan, Z. B. & Ş. Kültür (2019): Ethnoveterinary medicine in Turkey: a comprehensive review. Turk. J. Vet. Anim. Sci., 43: 555-582.
- European Medicines Agency (EMA) (2016): Efeublätter (Hedera helix L., folium). Pflanzliche Arzneimittel: Zusammenfassung für die Öffentlichkeit. EMA/827287/2015.
- European Medicines Agency (EMA) (2017): Assessment report on Hedera helix L. folium. EMA/HMPC/325715/2017. https://www.ema.europa.eu/en/documents/herbal-report/final-assessment-report-hedera-helix-l-folium-revision-2_en.pdf
- Facino, R. M., Carini, M., Stefani, R., Aldini, G. & L. Saibine (1995): Anti-elastase and antihyaluronidase activities of saponins and sapogenins from Hedera helix, Aesculus hippocastanum, Ruscus aculeatus: factors contributing to their efficiacy in the treatment of venous insufficiency. Arch. Pharm., 28: 720-724.
- Facino, R.M., Carini, M. & P. Bonadeo (1990): Efficiacy of topically applied Hedera helix L. saponins for treatment of liposclerosis (so-called cellulites). Acta Ther., 16: 337-349.
- Gatter, W., Ebenhöh, H., Kimo, R., Gatter, W. & F. Scherer (2020): 50-jährigeUuntersuchungen an migrierenden Schwebfliegen, Waffenfliegen und Schlupfwespen belegen extreme Rückgänge (Diptera: Syrphidae, Stratiomyidae; Hymenoptera: Ichneumonidae). Entomologische Zeitschrift, 130: 131-142.
- Gesundheit.com (2004): Phytosterole – rein pflanzliche Wirkstoffe gegen trockene Haut. gesundheit.com/gesundheit/alternative-medizin/1/phytosterole-rein-pflanzliche-wirkstoffe-gegen-trockene-haut
- González-Hernández, M. P. & F. J. Silva-Pando (1996): Grazing effects of ungulates in an Galician oak forest (northwest Spain). For. Ecol. Manag., 88: 65-70.
- González-Hernández, M. P. & F. J. Silva-Pando (1999): Nutritional attributes of understory plants known of deer diets. J. Range Manage., 52: 132-138.
- Gülçin, T., Mshvildadze, V., Gepdiremen, A. & R. Elias (2004): Antioxidant activity of saponins isolated from ivy: α-hederin, hederasaponin-C, hederacolchiside-E and hederacolchiside-F. Planta Med., 70: 561-563.
- Hexsel, D., Orlandi, C. & D. Zechmeester do Prado (2005): Botanical extracts used in the treatment of cellulite. Dermatol. Surg., 31: 866-872.
- Hexsel, D., Zechmeister do Prado, D., Roo, J., Goldman, M.P. (2006): Topical management of cellulite. In Goldman, M.P., Bacci, P.A., leibaschoff, G., Hexsel, D., Anglinii, F. (eds.): Cellulite Pathophysiology and Treatment, New York, Taylor and Francis Group, 159-170.
- Hintermeier, H. & Hintermeier, M. (2009): Blütenpflanzen und ihre Gäste, Teil 2. 2. Aufl., Hrsg.: Bayerischer Landesverband für Gartenbau und Landespflege e.V., München, 162 S.
- Hostettmann, K. (1980): Saponins with molluscicidal activity from Hedera helix L. Helvetica Chimica Acta, 63: 606-609.
- https://incidecoder.com/ingredients/hedera-helix-extract
- https://incidecoder.com/ingredients/hedera-helix-leaf-extract
- https://incidecoder.com/ingredients/hedera-helix-leaf-stem-extract
- https://incidecoder.com/ingredients/hedera-helix-stem-extract
- Huang, Y., Lenaghan, S., C., Xia, L., Burris, J. N., Stewart, Jr., C. N. & M. Zhang (2013): Characterization of physiochemical properties of ivy nanoparticles for cosmetic application. J. Nanobiotechnology, 11: 3, http://www.jnanobiotechnology.com/content/11/3.
- Huang,Y., Wang, Y.-J., Wang, Y., Yi, S., Fan, Z., Sun, L ,Lin, D., Anreddy, N., Zhu, H., Schmidt, M., Chen, Z.-S. & M. Zhang (2015): Exploring naturally occurring ivy nanoparticles as an alternative biomaterial. Acta Biomater., http://dx.ddoi.org/10.1016/j,actbio.2015.07.35
- Huang, Y., Wang, Y., Tan, L., Sun, L. & M. Zhang (2016): Nanospherical arabinogalactan proteins are a key component of the high strength adhesive secreted by English ivy. www.pnas.org(cgi/doi/10.1073/pnas.1600406113
- Iqbal Zafar, Parvez Mohammad, Asadullah, Ismail Muhammad, Ahmad Bashir, Zakir Shahida & Gul Saima (2002): Study of the hypoglycemic activity of Hedera helix L. in alloxan-induced diabetic rabbits. J. Med. Sci., 2: 206-208.
- Jacobs, J.H., Clark, S. J., Denholm, I., Goulson, D., Stoate, C. & J. L. Osborne (2009): Pollination biology of fruit-bearing hedgerow plants and the role of flower visiting insects in fruit-set. Ann. Bot., 104: 1397-1404.
- Jayamani, J. Naisini, A., Madhan, B. & G. Shanmujam (2018): Ferulic acid, a natural phenolic compound, as a potential inhibitor for collagen fribrilformation and its propagation. Int. J. Biol. Macromol., 113: 277-284.
- Julien, J., Gasquet, M., Maillard, C., Balansard, G. Timon-David, P. (1985): Extracts oft the ivy plant, Hedera helix, and their anthelmintic activity on liver flukes. Plant Med., 3: 205-208.
- Kaczmarek, B., Lewandowska, K. & A. Sionkowska (2020): Modificaton of collagen properties with ferulic acid. Materials 13, 3419; doi:10.3390/ma13153419
- Karg, S. & E. Weber (2019): Heilsam, kleidsam, wundersam. Wbg Theiss, 112 S.
- Khaled Nabih Zaki Rashed (2013): Antioxidant activity of hedera helix L. extract and the main phytoconstituents. International Journal of Allied Medical Sciences and Clinical Research (IJAMSCR), 1: 62-64.
- Kranvogel, A. (2013): Zur feldmäßigen Inkulturnahme von Efeu (Hedera helix L. Araliaceae), VVB Laufenweiler Verlag, Giessen.
- Kugler, H. (1970): Blütenökologie, Gustav Fischer Verlag, Stuttgart, 2. Aufl. 345 S.
- Lautenschläger, H. (2016): Saponine in der Hautpflege. medical Beauty Forum 2016(1): 12-16.
- Lenaghan, S. C., Burris, J. N., Choury, K., Huang, Y., Xia, L., Lady, B., Sharmo, R., Pan, C., Leleune, Z., Foister, S., Hettich, R. L., Stewart, Jr. C. N. & M. Zhang (2013): Isolation and chemical analysis of nanoparticles from Enlish ivy (Hedea helix L.). J. P. Soc. Interface, 10: 20130392. http://dx.doi,org/10.1098/rsif.2013.0392
- Li, Q., Xia, L., Zhang, Z. & M. Zhang (2010): Ultraviolet extinction and visible transparency by ivy nanoparticles. Nanoscale Res. Lett., 5: 1487-1491.
- Lindman, C. A. M. (1901-1905): Bilder ur Nordens Flora.
- Lutsenko, Y., Bylka, W., Matławska, I. & R. Darmohray (2010): Hedera helix as a medicinal plant. Herba Pol., 56: 83-96.
- Maftei, E. A., Ionescu, E., Sauciuc, A. & A. T. Vi (2006): Anticellulite and adipose tissue reducing cosmetic compositon. RO 121004 B1 200061 130.
- Magnani, C., Isaak, V. L. B., Correa, M. A.& H. R. N. Salgado (2014): Caffeic acid: a review of its potential use in medications and cosmetic. Anal. Methods, 6: 3203-3210.
- Majester-Savornin, B., Elias, R., Diaz-Lanza, A.M., Balansard, G., Gasquet, M. & F. Delmas, F. (1991): Saponins of the ivy plant, Hedera helix, and their leishmanicidic activity. Planta Med., 57: 260-262.
- Metcalfe, D.J. (2005): Hedera helix L. J. Ecol., 93: 632-648.
- Moshail-Nezhad, P., Faed Maleki, F., Hosseini, S.M., Yahypour, M., Iman, M. & A. Khamesipour (2019): Hepaprotective and antioxidant effects of Hedera helix extract on acetaminophen induced oxidative stress and hepatotoxicity in mice. Biotech. Histochem., 94: 313-319.
- Motaghi, S., Sadeghi, M., Seyyedin, S., Sepehri, G & R. Kheirandish (2018): Histomorphometrical and histopathological evaluation of Hedera helix alcoholic extract on dermal collagen bundles. Anat. Sci. Int., 15: 55-62.
- Oleffe, P.E., Blanchart, G., Picard, J. & B. Boisaubert (1993): Nutritive value of forest plants for red deer (Cervus elaphus) and roe deer (Capreolus capreolus) in autumn. Gibier Faune Sauvage, 10: 303-318.
- Pârvu, M., Vlase, L., Pârvu, A. E., Roşca-Casian, O., Gheldiu, A.-M. & O. Pârvu (2015): Phenolic compounds and antifungal activity of Hedera helix L. (ivy) flowers and fruits. Not. Bot. Horri. Agrobo., 43: 53-58.
- Patents.google.com/patent/CN105596282A/en: Facial cleanser with freckle removing and skin whitening function.
- Petrischak, H. (2015): Blütenbesuchende Insekten an Efeu (Hedera helix). Entomologie heute, 27: 103-123.
- Pop, C. E., Pârvu, M., Arsene, A.L., Pârvu, A.E., Vodnar, D.C., Tarcea, M. Toiu, A.M. & L. Vlase (2017): Investigation of antioxidant and antimicrobial potential of some extracts from Hedera helix L. Farmacia, 65: 624-629.
- Rai, A. (2013): The antiinflammatory and antiarhtritic properties of ethanolic extract of Hedera helix. Indian J. Pharm. Sci,. 75: 99-102.
- Rashed, K., Luo, M.-T., Zhang, L.-T. & Y.T. Zheng (2013): Inhibition of human immundeficiency virus (HIV-1) by Hedera helix L. extracts and phytoconstituents. Int. J. Mol. Biol. Biochem., 1: 1-7.
- Reckhaus, H.-D. (2019): Warum jede Fliege zählt – Wert und Bedrohung von Insekten. 5. Aufl. Gais, Bielefeld: Insekt Respect Eigenverlag, 214 S.
- Roşca-Casian, O., Mircea, C., Vlase, L., Gheldiu, A.-M., Teuca, D.T. & M. Pârvu (2017): Chemical composition and antifungal activity of Hedera helix leaf ethanolic extract. Acta Biol. Hung., 68: 196-207.
- Runkel, F., Schneider, W., Schmidt, O. & G. M. Engelhard (2005): Method for the preparation of formulation that contain α-hederin and hederacoside C from ivy leaves. DE 10345343 A120050414.
- Sage, R.B., Hollens, K.,Gregory, C.C. Woodburn, M.I.A. & J.P. Carroll (2004): Impact of roe deer (Capreolus capreolus) browsing on understory vegetation in small farm woodlands. https://bioone.org/journals/Wildlife-Biology
- Saiah, H., Allem, R. & F.Z. El Kebir (2015): Antioxidant and antibacterial activities of six Algerian medicinal plants. Int. J. Pharm. Pharm. Sci., 8: 367-374.
- Saed Khan, S, Abdil, A., Naem, S., Jaffar, N., Khatoon, Ah., Ansar, H. & Y. Shafiq (2020): Evaluation of acute and chronic antidiabetic activity of Ivy (Hedera helixL.) aqueous leaf extract in rat modell. Pak. J. Biol. Sci. 23: 1357-1368.
- Schilcher, H. & S. Kammerer (2003): Leitfaden Phytotherapie. 2. Aufl., Urban & Fischer, München, 998 S.
- Schönfelder, I. & Schönfelder, P. (2004): Das neue Handbuch der Heilpflanzenbuch. Kosmos-Verlag, Stuttgart, 502 S.
- Schönfelder, I. & Schönfelder, P. (2010): Der Kosmos Heilpflanzenführer. Kosmos-Verlag, Stuttgart, 446 S.
- Schulte-Michels, J., Keksel, C., Häberlein, H. & S. Franken (2018): Anti-inflammatory effects of ivy leave dry extract: influence on transcriptional activity of NFKB. Inflammopharmacology, 27: 339-347.
- Schuster, G., Smits, W. & J. Ullal (2007): Die Denker des Dschungels. Tandem Verlag GmbH, 320 S.
- Shokry, A., El-Shiekh, R., Kamel, G. & A. Ramadan (2021): Phytochemical contents, biological activities and therapeutic applications of Hedera helix (Ivy) leaves extracts: a review. The Natural Products Journal, 12: 22.32.
- Simmons, I. G. & G. W. Dimbleby (1974): The possible role of ivy (hedera helix L.) in the mesolithic economy of Western Europe. J. Archaeol. Sci., 1: 291-296.
- Snow, B. & D. Snow (2010): Birds and berries. Bloomsbury Publishing, 268 S.
- Song,J. H., Yeo, S.-G., Hong, E.-H., Lee, B.-R., Kim, J.-W., Kim, J. H., Jeong, H.G., Kwon, Y. S., Kim, H.P., Lee, S. W., Park, J.-H. & H.-J. Ko (2014): Antiviral activity of Hederasaponin B from Hedera helix against Enterovirus 71 subgenotypes C3 and C4a. Biomed. Ther., 22: 41-46.
- Soualeh, N., Stiévenard, A., Boudelaire, E., Bouaged, J. & R. Souliman (2018): Powders with small microparticle size from Hedea helix and Scrophularia nodosa exhibited high preventive antioxidant activity against H2O2-inducedoxidative stress in mouse primary spleen cells. Int. J Vitam. Nutr. Res., 88: 208-218.
- Spagnol, C. M., Di Filippo, L. D., Isaak, V. L.B. Correa, M.A. & H. R. N. Salgado (2017): Coffeic acid in dermatologicaalformulations: In vitrorelease profile and skin absorption. Com. Chem. High.Throughout Screen, 20: 675-681.
- SpecialChem (2021): Hedera helix leaf extract.https://cosmetics.specialchem.com/inci-ingredients/hedera-helix-extract
- Strelau, M., Clements, D. R., Benner, J. & R. Prasad (2018): The biology of Canadian weeds: 157. Hedera helix. L. and Hedera hibernica (G. Kirchn.) Bean. Can. J. Plant Sci., 98: 1005-1022.
- Suica-Bunghez, I. R., Sorescu, A. A., Doneca, S. M., Constantin, M., Raut, I. & R. M. Ion (2020): Phytochemical, antioxidant and antimicrobial characterization of Heder helix L. extract. J. Plant Dev., 27: 47-53.
- Süleyman, H., Mshvildadze, V., Gepdiremen, A. & R. Elias (2003): Acute and chronic antiinflammatory profile of the ivy plant, Hedera helix, in rats. Phytomedicine, 10: 370-374.
- Tixier, H., Duncan, P., Sakovix, J. Yant, A., Gleizes, M. & M. Lila (2009): Food selected by European roe deer (Capreolus capreolus): effects of plant chemistry and consequences for the nutrition value of the diet. J. Zool., 242, 229-245.
- Traversier, R. (2014): Westliche Pflanzen und ihre Wirkung in der TCM. Haug, 472 S.
- Trute, A. & A. Nahrstedt (1997): Identification and quantitative analysis of phenolic compounds from the dry extract of Heder helix. Planta Med., 63: 177-179.
- Uddin, G., Rauf, A., Qaisar, M., Rehmann, T. U., Latif, A. & M. Ali (2011): Prelimary phytochemical screening and antimicrobial activity of Hedera helix L. Middle East. J. Sci. Res., 8: 198-202.
- United States patent 20070031516 A1 USA A61K36/24; A61K31/7048; A61K36/899. Composition for the prevention and treatment of cellulitis/A. Garcice, M. Jose, P. Cebrian/ES/.- Application Number: 1o/551010.-Filing Date: 03/18/2004; Publication Date: 02/08/2007.
- Urbanovsky, C. & Le Scouëzec, G. (2008): Der Garten der Druiden. Das geheime Kräuterwissen der keltischen Heiler. Allegria, Ullstein GmbH, Berlin, 494 S.
- Wagner, H. (1999): Arzneidrogen und ihre Inhaltsstoffe. 6. Aufl. Stuttgart, Wiss. Verl.-Ges., 648 S.
- Westrich, P. (2018): Die Wildbienen Deutschlands. Eugen Ulmer, Stuttgart, 821 S.
- Wichtl, M. (2004): Herbal drugs and phytopharmaceuticals. A Handbook for Practice on a Scientific Basis, 3rd ed., Stuttgart.
- Wink, M. (2015): Sekundärstoffe – die Geheimwaffen der Pflanzen. Biol. Unserer Zeit, 45: 225-235.
- www.haut.de
- www.incibeauty.com
100. www.kosmetik-transparent.at
101. https://berlin.nabu.de/tiere-und-pflanzen
103. www.hornissenschutz.de (Thomas Rickinger)
104. www.hornissenschutz.ch (Hrsg. Andi Roost)
105. www.natur-in-nrw.de
106. www.insektenbox.de
107. Xia, L., Lenaghan, S.C., Zhang, M., Zhang, Z.,Li, Q. (2010): Naturally occuring nanoparticles from English ivy: an alternative to metal-based nanoparticles for UV-protection. Journal of Nanobiotechnology, 8:
http://www.jnanobiotechnology.com/content/8/1/12
108. Zduńska,K., Dana, A., Kolodziejczak, A. & H. Rotsztejn (2018): Antioxidant properties of ferulic acid and ist possible
application. Skin Pharmacol. Physiol., 31: 332-336.
109. Zhang, M. Liu, M. Prest, H. & St. Fischer (2008): Nanoparticles secreted from ivy rootlets for surface climbing.
Nano Lett., 8: 1277-1286.
